陈丽君 | 中国生物医药企业出海知识产权管理、布局策略及风险管控
Date:•Hits:1300 • YIPEVENTS
在21日的会前研讨会上,上海君实生物医药科技有限公司知识产权总监陈丽君结合其多年的研发工作实践与知识产权工作经验,与大家分享我国生物医药企业出海知识产权管理、布局策略及风险管控的一些经验。
知产前沿现将陈总监的现场主题发言内容整理成文,供医药知识产权从业人员参考学习。
如需购买第七届中国医药知识产权峰会直播回顾,请后台私信“CPIPS 2022”
目次
一、中国生物医药企业走出去
二、生物医药企业出海之——IP Protection
三、生物医药企业出海之——监管排他权(Regulatory Exclusivity)
一、中国生物医药企业走出去
众所周知,在目前的医保和集采的双重政策下,我国的生物医药企业在发展过程中形成了非常严重的价格和产品双内卷。因此,创新型医药企业想要获得长足的发展和利润,“走出去”已经成为必然的选择。
一般来讲,生物医药企业走出去的模式大致可分为三种模式:
- 第一种模式是自主出海,在这种模式下,企业自建临床团队在海外做临床研究,自建销售团队在海外自主销售。
- 第二种模式是License out,即企业将自己的产品及IP许可给海外合作者,收取upfront,milestone以及royalty,目前我国大多数创新型的药企都是以这种方式出海的。
- 第三种模式是合作出海,在这种模式下,企业与海外的合作伙伴共担费用,共担风险,共享利益。
当然,不管是以哪种方式出海,不可避免的需要讨论两个问题,即底层创新能力和创新刺激机制。所谓底层创新能力,即企业能否在全球靶点研发竞争中名列前茅。一般来说,想要在全球市场上占据优势,一个靶点的前5个竞争者才能够在定价或销售上占有一定的优势。其次是在出海发展的过程中,企业对于创新刺激机制是否进行了有效利用?比如IP的保护、监管排他权的利用等都是需要综合考虑的因素,通过对于各种策略的使用,以尽量延长产品的生命周期。
二、生物医药企业出海之——IP Protection
对于我们来说,知识产权不管是政府层面,还是企业层面都是一个舶来品。国内企业通过在学习海外MNC专利布局策略的基础上,逐渐形成自己企业内部的知识产权管理与布局的策略。在此以史上专利布局最成功的案例之一,阿达木单抗(修美乐,Humira)的专利布局为例来说明如何设计一个好的专利布局策略。
在美国,从1996年首次提交阿达木单抗的分子序列专利申请至2020年25年间,AbbVie在修美乐上获得的授权专利大约有130多件。但是,从1996至2002年(Humira首次在美国获得批准上市)的6年之间,AbbVie在修美乐上仅仅布局了约10件专利,而从2002年修美乐首次获得FDA批准之后,随着修美乐临床试验的不断开展,适应症的不断扩大,AbbVie围绕该产品布局了大量的外围专利,尤其是在2010年到2015年期间,布局了将近100件专利。
正如AbbVie自己所说的,Humira巨大的市场成功主要取决于两个方面,一个是完善而成功的专利布局,一个是广泛的适应症。正是因为在这两个方面的成功,使公司在全球,尤其是在美国市场获得了巨大的利润。
同时,完善的专利布局阻挡了生物类似药的上市,延迟了专利悬崖的到来。修美乐的生物类似药在欧洲早在2018年就获批上市,但是直到2023年,美国才会有修美乐的生物类似物上市销售。由此可以看出,通过严密的专利布局,可以阻挡竞争对手进入市场。
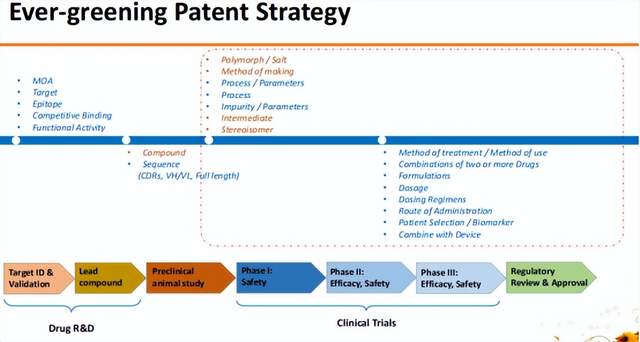
Humira的成功告诉我们好的专利布局策略的重要性。那么说到什么是好的专利布局策略?就不得不提 Ever-greening Patent 策略了,在药物研发的全过程中,伴随不同的阶段,可以布局不同类型的专利,从而形成完整的ever-greening布局。
比如,靶点发现及验证阶段可能发现新的MOA,此时可以进行机制、功能、表位等大范围专利的布局;先导化合物发现之后,可以布局核心分子专利或化合物专利;临床前研究开发阶段,小分子领域可以进行晶型、盐型、制备方法、工艺及参数、纯化及参数或中体、光学异构体专利的布局;而在临床开发阶段,可以进行治疗用途、联合用药、制剂等类型的专利布局,还可以就剂量方案、给药方式、病人人群的选择、与仪器联用等方面进行专利布局。即在整个的药物开发过程中,伴随药物不同的开发节点,可以在不同节点布局相应类型的专利,从而延长产品的生命周期。
除此之外,企业可以利用各个国家的专利政策,比如分案申请、延续申请、部分延续申请等方式对于重要的专利及其家族进行多角度的权利要求布局,即建立一个专利家族的专利丛林。
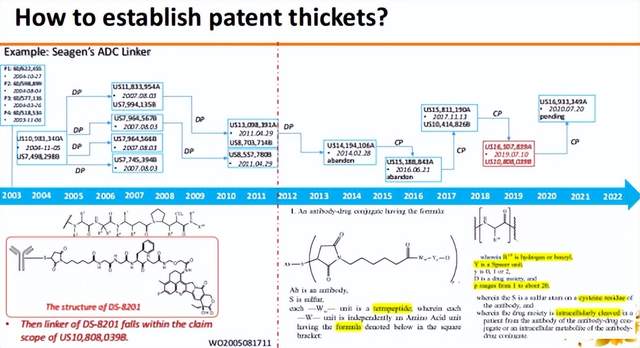
那么,如何建立专利丛林,以Seagen的ADC Linker专利家族为例。今年年初Seagen在美国德州地区法院起诉第一三共株式会社的ADC药物ENHERTU®侵犯其美国专利US10,808,039。分析这个热门的案子,我们发现随着第一三共株式会社的DS-8201在临床上取得巨大成功,Seagen于2019年在其延续申请中修改了专利要求,修改后的权利要求覆盖了DS-8201使用的Linker结构。涉诉专利的美国临时申请最早是在2003年提交的,其正式申请是于2004年提交,即US7,498,298,针对该美国申请,Seagen提交了4个分案申请,其后续运用分案申请和延续申请策略,一直保持至少一件处于未决状态的申请,等待竞争对手的产品开发进度,根据对手产品的开发进度来决定如何修改权利要求,以便在权利要求中囊括竞争对手的产品,从而达到阻挡对手的效果。
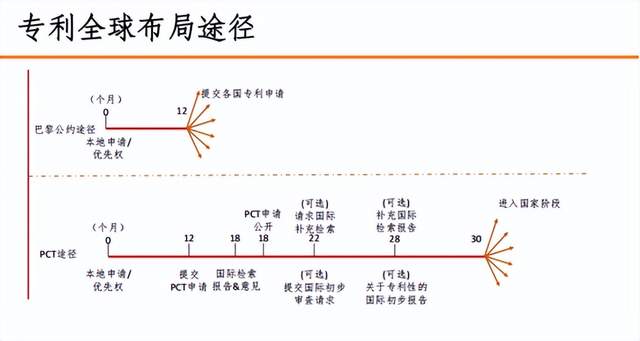
众所周知,完整的专利布局一定是全球性的,而专利全球布局一般常用的有两种途径,包括巴黎公约途径和PCT途径。那么,企业到哪里去做专利布局?如何选择哪些国家进行布局?这是一个company-by-company, product-by-product, case-by-case为基础讨论的问题。
首先,任何公司对于某个产品、某件专利申请都需要平衡保护范围和成本。其次,哪些国家和地区是企业想要阻挡竞争对手或第三方进入的。再次,从企业自身角度,需要充分考虑各种要素,包括:自己产品的商业计划以及市场在哪里?竞争对手的主要市场在哪里?自己的生产地在哪里?竞争对手的生产地在哪里?当地的专利政策和专利可实施性如何?当地的经济、人口、医保政策如何?当地的药品定价体系如何?是否为自主定价体系还是政府过度干预的定价体系?当地的流行病学/发病率如何?是否存在可能的合作伙伴?以及其他IP权利,比如商标等的获权的难易程度等。总之,IP策略是基于企业自己的研发和商业策略来确定的。
具体来说,可以将产品进行分类、分区域考虑。比如,基于产品的特性,综合考虑上述因素的基础上,认为第一梯队是美国、欧洲、中国这三个最主要关注的市场;第二梯队为加拿大、韩国、日本、澳大利亚、南非、俄罗斯、印度等几个国家;第三梯队主要是东南亚地区;第四梯队是拉美地区,比如阿根廷、巴西、墨西哥等国家;第五梯队是中东和北非地区。
进一步需要考虑的问题是哪些主题在哪些区域是被允许的,原则就是:Case-by-case,Country-by-country。比如化合物专利、分子序列专利,在全球绝大部分国家和地区都是可专利的主题。但是第二医药用途专利在各个国家的差异比较大,在大多数发达国家都是被允许的主题,但是在东南亚、拉美的很多国家是不被允许的主题,所以在专利布局的时候就要考虑到这一点。
具体来说,第二医药用途专利在大多数东南亚国家中是被允许的主题,但在越南和印度尼西亚是不允许的;拉美大部分国家是不允许的,但巴西、智利、墨西哥和巴拿马是例外;中东国家基本上是不允许的。而在印度由于其不太支持ever-greening策略,审查较为严格,第二医药用途专利也不被允许。
讨论完去哪里布局,接着便是什么时候提交申请的问题,总体来讲宜早不宜迟。重点考虑的要素主要包括:第一,所在领域的竞争激烈程度;第二,现有技术情况,up-coming disclosure;第三,最早优先权日和支持性的平衡;第四,避免自我冲突;第五,12个月内可以完成的内容,即能否在提交首件申请的12个月内进行补充......
三、生物医药企业出海之——监管排他权(Regulatory Exclusivity)
由于企业IP的预算是有限的,那么企业就需要考量在该选定地区做专利布局,还是通过其他途径来进行相应的保护。此时就可以综合考虑专利保护和监管排他保护。
Regulatory Exclusivity主要可以分为四个类型:(1)数据保护:在数据保护期内监管机构不接受任何申请;(2)市场独占:在该期限内可以接受申请但不批准;(3)孤儿药的独占期;(4)儿科用药的独占期,该独占期不能单独存在。
关于独占期,各国都有不同的规定,下述主要总结中国、欧盟和美国的独占期的规则。
在美国,小分子药物的数据独占期一般是5年,可能有一年或两年的市场独占期;其中开发新的适应症、选择新的人群、开发新剂型、或新的给药方案以及处方药的OTC替换都会有3年的市场独占期;生物制剂有4年的数据独占期和8年的市场独占期,共计12年;如果做了儿科用药研究,还有6个月的儿科用药独占期;另外孤儿药的独占期是7年。
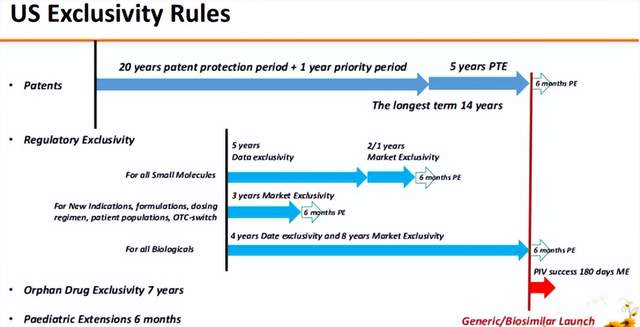
欧盟的独占期规则也比较相似,但不区分小分子和大分子,为8+2+1的数据独占期和市场独占期;但孤儿药的独占期长达10年;儿科用药的独占期依旧是6个月。
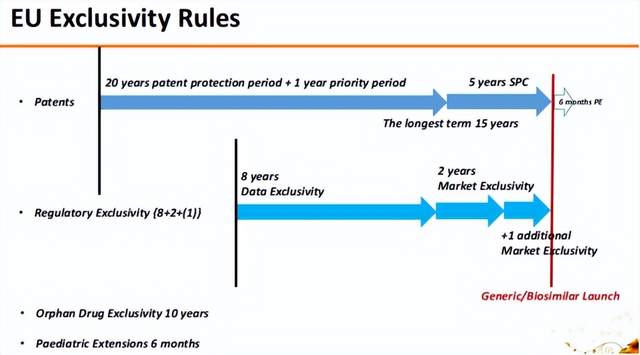
我国今年五月份公布的《药品管理法实施条例》(征求意见稿)中也提到了数据独占期的问题。但其中仅提及新化学实体有6年的数据独占期,孤儿药独占期为7年,儿科用药独占期为12个月。
总体来说,两个创新刺激机制在企业内部都是应该考量的。IP in-house需要与企业其他部门进行沟通,设计专利进入的国家和类型,与监管独占期结合来延长产品的生命周期。
最后,企业的IP日常工作中,在风险防控方面也有许多值得关注的点。比如需要在出版物、演示、临床试验登记等事项之前进行审核把控,避免将相关的发明点和数据提前公开。
另外,生物医药企业在很多国家都有自己的研发中心,多国研发中心的员工合作完成的发明,专利到底在哪个国家先提交都是需要事先考虑的。最后强调的是在License等过程中,涉及IP DD时,企业内部的防火墙机制非常重要,避免可能出现IP归属不清楚的情况。

编辑:Sharon





